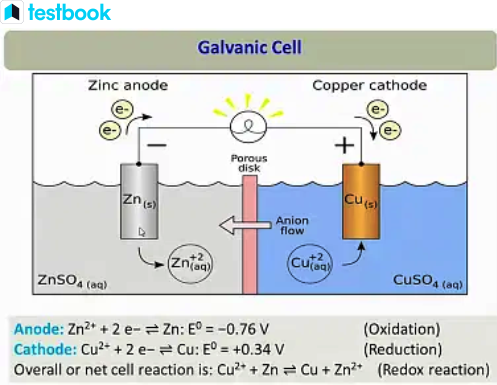
La corrosión galvánica es un fenómeno que ocurre cuando dos metales diferentes están acoplados entre sí en la atmósfera o en agua. En este proceso, uno de los metales se convierte en el cátodo (el más noble) y el otro en el ánodo (el más activo).
Se establece un flujo de corriente medible entre el ánodo y el cátodo, lo que resulta en un aumento en la velocidad de corrosión del ánodo y una disminución en la velocidad de corrosión del cátodo. Si no se tienen en cuenta las condiciones adecuadas, la corrosión galvánica puede provocar fallas inesperadas.
Elementos Requeridos para la Corrosión Galvánica
Para que ocurra la corrosión galvánica, se requieren tres elementos:
- Dos metales con diferentes potenciales de corrosión.
- Contacto eléctrico directo entre los metales.
- Una solución electrolítica conductora (como agua) que conecte regularmente los dos metales. Esta solución electrolítica crea un “camino conductor”. Por ejemplo, la inmersión regular, la condensación, la exposición a la lluvia o la niebla, u otras fuentes de humedad que conecten y humedezcan los dos metales.
Corrosión Galvánica Definición
La corrosión galvánica se refiere al proceso electroquímico en el cual dos metales diferentes, en contacto directo y expuestos a un electrolito conductor, como agua o humedad atmosférica, experimentan una aceleración de la corrosión en el metal más activo (ánodo) y una inhibición en el metal más noble (cátodo).

Este fenómeno se debe al flujo de corriente eléctrica que se establece entre los metales, lo que puede provocar daños y fallas en las estructuras y equipos.
Condiciones que Impiden la Corrosión Galvánica
Si falta alguno de estos elementos, no puede ocurrir la corrosión galvánica. Si, por ejemplo, se evita el contacto directo entre los dos metales (mediante el uso de una arandela de plástico, una capa de pintura, etc.) o si hay alguna interrupción en el camino conductor, no habrá corrosión galvánica y cada metal corroerá a su velocidad normal en ese entorno de servicio.
Predicción de la Corrosión Galvánica mediante la Serie Galvánica
La corrosión galvánica se puede predecir utilizando una “serie galvánica” cuando se acoplan dos metales diferentes en la atmósfera o en agua.
Cuando dos metales están más separados en la lista de la serie galvánica (es decir, hay una mayor diferencia entre los dos números), aumenta la fuerza impulsora para la corrosión galvánica.
Los metales más anódicos (activos) se encuentran en la parte superior de la lista, mientras que los más catódicos (nobles) se encuentran en la parte inferior. En la mayoría de las aplicaciones, donde se combinan metales diferentes, se debe utilizar la barra pasiva (sólida) para determinar la posición del acero inoxidable.
Importancia del Área Superficial y Ejemplos de Corrosión Galvánica
Además de los tres elementos mencionados anteriormente, el área superficial relativa (no la masa) de cada uno de los metales expuestos también es un factor importante en la corrosión galvánica.
Si el área del cátodo (metal noble) es muy grande y el área del ánodo (metal activo) es muy pequeña, es probable que se produzca una corriente muy alta y que el ánodo se corroa rápidamente.
Es importante evitar combinaciones de metales diferentes en áreas donde es probable que se acumule humedad durante largos períodos. En aplicaciones exteriores bien drenadas, se pueden utilizar metales diferentes juntos si existen proporciones favorables de superficie, pero la mejor solución es aislar eléctricamente uno del otro.
Cuando se sueldan acero al carbono y acero inoxidable pintados juntos, la junta soldada debe ser pintada. Los sujetadores de acero inoxidable con arandelas de neopreno u otro material inerte se utilizan regularmente con otros metales para evitar la corrosión galvánica.
La investigación ha demostrado que la corrosión galvánica no es un problema entre acero inoxidable y acero al carbono en concreto.
Ejemplos famosos de corrosión galvánica incluyen la Estatua de la Libertad, donde el contacto directo entre el cobre y el hierro fundido causó daños significativos hasta que se reconstruyó utilizando acero inoxidable dúplex, y la combinación de aluminio y zinc, que puede acelerar la corrosión del aluminio en presencia de humedad.